This content has been archived. It may no longer be relevant

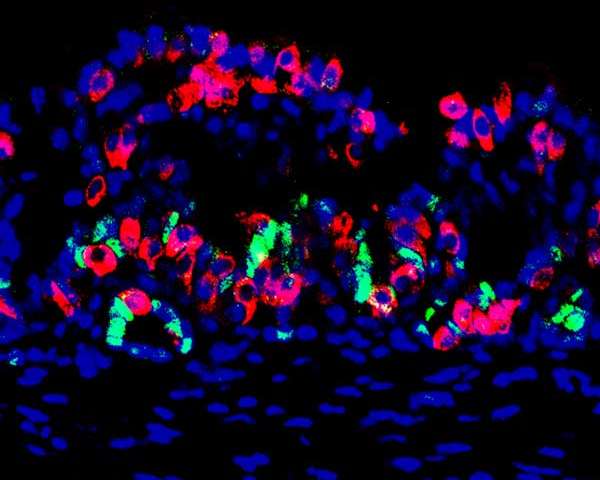
Una sezione gastrica del mini-organo progettato per produrre cellule che secernono insulina, con colorazione a immunofluorescenza. Questa immagine mostra molte cellule che producono insulina indotta (rosso) presenti nel mini-organo. staminali gastriche e cellule progenitrici (verde) vengono rilevate alla base delle ghiandole. nuclei delle cellule etichettati in blu. Credit: Chaiyaboot Ariyachet
I ricercatori hanno trascorso decenni cercando di sostituire le cellule del pancreas che producono insulina, chiamate cellule beta, che si perdono nel diabete di tipo 1. Ora un team di ricercatori segnala il 18 febbraio 2016 in Cell Stem Cell , di aver scoperto che il tessuto dallo stomaco inferiore ha un grande potenziale di possibilità per essere riprogrammato in produttore di beta-cellule. I ricercatori hanno prelevato campioni di questo tessuto dai topi e lì han fatto crescere “mini-organi” i quali producono l’insulina quando trapiantati nuovamente dentro agli animali. Le cellule staminali nei “mini-organi” hanno continuato a rifornire la popolazione di cellule che producono insulina, dando al tessuto una spinta rigenerativa sostenibile.
Trovato il tessuto nel corpo più suscettibile alla riprogrammazione per la produzione di insulina, i ricercatori hanno modificato geneticamente i topi così da esprimere tre geni che possono trasformare altri tipi di cellule in cellule beta. “Abbiamo esaminato tutto, dal naso alla coda del topo”, dice l’autore senior Qiao Zhou, dell’Università di Harvard Dipartimento di cellule staminali e biologia rigenerativa. “Abbiamo scoperto, sorprendentemente, che alcune delle celle nella regione del piloro dello stomaco sono più suscettibili alla conversione delle cellule beta. Questo tessuto sembra essere il migliore materiale di partenza.”
La regione del piloro collega lo stomaco all’intestino tenue. Quando riprogrammate, le cellule in questo settore sono stati i più sensibili ai livelli elevati di glucosio , e alla produzione di insulina per normalizzare lo zucchero nel sangue del topo. Per verificare l’efficacia delle cellule, i ricercatori hanno distrutto le cellule beta del pancreas dei topi, costringendo i loro corpi a fare affidamento solo sulle cellule dello stomaco alterate. Gli animali di controllo, senza riprogrammazione dei tessuti, sono morti entro otto settimane. Ma le cellule sperimentali riprogrammate dei topi hanno mantenuto l’insulina e i livelli del glucosio nel sangue finché gli animali sono stati monitorati su sei mesi.
Il piloro dello stomaco ha un altro vantaggio: le cellule staminali rinnovano naturalmente il tessuto intestinale su base regolare. Quando le cellule nello regione pilorica esprimono i geni di conversione, e la prima serie di cellule riprogrammate sperimentalmente sono distrutte, le cellule staminali della regione “rinfrescano” la popolazione di cellule che producono insulina. “In diversi stati della malattia, si dispone di una costante perdita di cellule beta”, dice Zhou. “Forniamo, in linea di principio, un vantaggio per ricostituirle.”
Ma per avvicinarsi a una potenziale terapia, Zhou ed i suoi colleghi hanno dovuto adottare un approccio diverso. “Quando il topo è cresciuto e diviene adulto, abbiamo acceso i tre geni. Ma in termini di un futuro impiego clinico, non si può fare un essere umano transgenico,” dice. Così i ricercatori hanno preso il tessuto dello stomaco dai topi, ingegnerizzato per esprimere i fattori di riprogrammazione delle cellule beta in laboratorio, e blandito le cellule a crescere in una piccola pallina di un mini-stomaco sia per produrre insulina che rinfrescarle con le cellule staminali . La
squadra quindi ha posto questi mini-organi nella membrana che ricopre l’interno della cavità addominale del topo.
Quando il team di ricerca ha distrutto le cellule pancreatiche dei topi per vedere se i mini-organi le avrebbero compensate, hanno trovato che i livelli di glucosio sono rimasti normali in cinque dei 22 animali da esperimento, e ciò era atteso come dato di riuscita per il test.
Il potenziale di produzione di insulina delle cellule dello stomaco pilorico probabilmente deriva dalla loro somiglianza alle cellule beta naturali del pancreas. I ricercatori hanno scoperto che molti geni critici per la funzione delle cellule beta sono normalmente espressi in cellule che producono l’ormone del piloro. “Quello rende possibile un approccio di impianto tramite biopsia in una persona, per far crescere le cellule in vitro e riprogrammarle a cellule beta , e poi trapiantarle per creare una terapia specifica per il paziente”, dice Zhou. “Questo è quello su cui stiamo lavorando ora. Siamo molto eccitati.”